上海海洋大学团队首次揭示软骨鱼类感短波基因丢失的适应性进化机制
发布日期:2025-08-21
浏览次数:20
8月18日,我校鲍宝龙、李云凯团队合作的研究论文“Adaptive loss of shortwave-sensitive opsins during cartilaginous fish evolution”(文章链接:Adaptive loss of shortwave-sensitive opsins during cartilaginous fish evolution | Nature Communications)以精选论文形式发表在国际学术期刊《自然·通讯》(Nature Communications),该项工作发现依赖短波视蛋白的短波光导致视网膜感光细胞的衰老,探究了鲨鱼等软骨鱼类感短波基因丢失的适应性演化机制,揭示了鲨鱼为什么不能感蓝光和紫光的长期谜团。
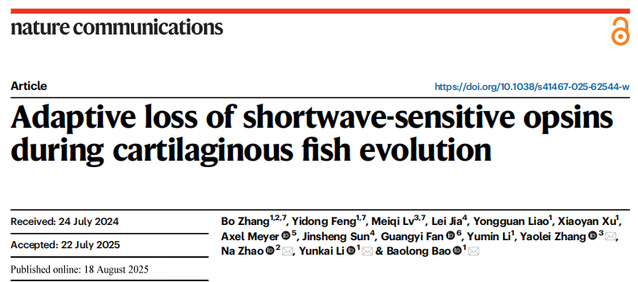
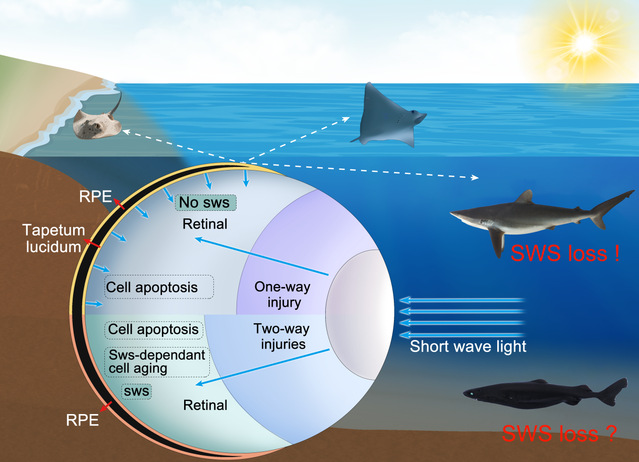
鲨、鳐等软骨鱼类不能看见蓝色和紫色,目前16种软骨鱼类基因组中都没有发现感蓝光和紫光的视锥视蛋白基因(sws),尤其是鳐形目缺乏代表性物种的全基因组信息,为了全面了解sws基因在软骨鱼类基因组中的演化机制,该研究建立了孔鳐(Okamejei kenojei )和大青鲨(Prionace glauca)的高精度全基因组图谱,发现感短波光的sws基因都丢失,感紫光的sws1和感蓝光的sws2基因丢失伴随了临近基因的复杂重排。
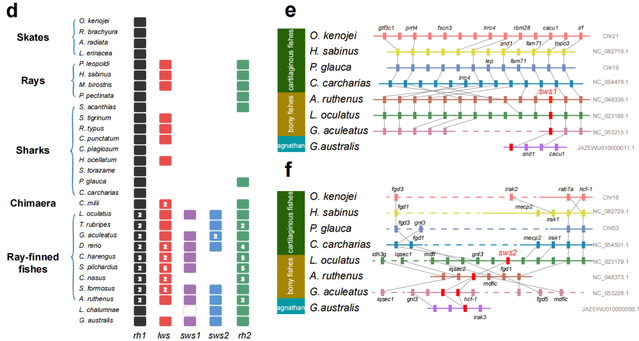
利用基因编辑技术分别敲除感蓝光的sws2和感紫光的sws1,建立斑马鱼缺失突变系sws2-/- 和sws1-/-,分别用蓝光和紫光照射,相比野生型斑马鱼,短波光照射sws敲除斑马鱼视网膜感光层的厚度和细胞数目都增加了,衰老标记基因和蛋白的表达都下调了,表明短波光是通过SWS诱导感光细胞衰老,导致视网膜细胞数量变少,视网膜变薄。
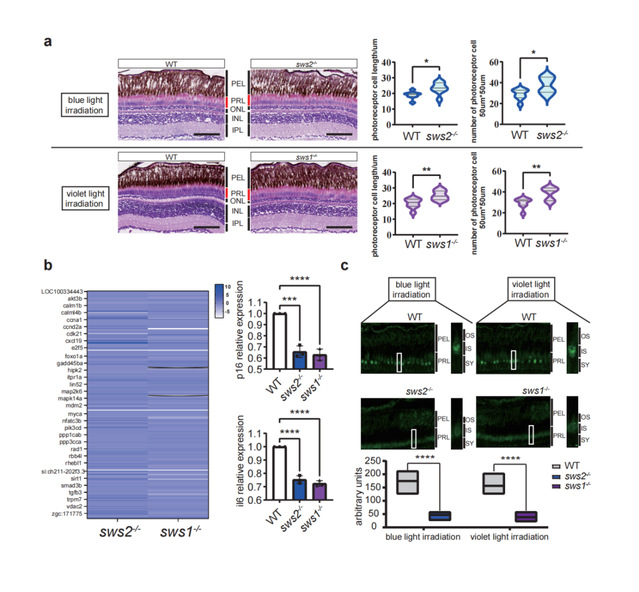
进一步在人细胞系中过表达斑马鱼的sws1和sws2基因以及人sws基因,β-半乳糖苷酶活性和细胞衰老标记蛋白p16免疫组化均显示短波光照射通过SWS加剧细胞的衰老。
最原始的脊椎动物圆口类有sws1和sws2,为什么软骨鱼类都丢失呢?这是因为从软骨鱼类开始演化出反光膜(tapetum lucidum),又称“照膜”,可以使光线反射回视网膜,增强感光能力,也会加剧短波光对眼睛感光细胞的衰老,导致视网膜损伤。现生软骨鱼类大多数生活在光谱比较丰富的近海和海洋上层,软骨鱼类选择通过丢失SWS减少近海强烈的短波光对眼睛的损伤,又可以通过保留LWS或RH2视蛋白来具备感受红光或黄绿光的能力,因此,鲨鱼等软骨鱼类sws基因的丢失,不是人们熟悉的性状退化的基因丢失,而是一种适应性演化丢失,支持“less-is-more”的演化假说。
年龄相关性黄斑变性(age-related macular degeneration,AMD)导致视力急剧下降,甚至失明,给患者的生活带来极大的困扰,是老龄化社会中不容忽视的眼科疾病问题,2040年全球AMD患者数量预计将达到2.88亿例。视网膜感光层变薄,是人类年龄相关黄斑变性的早期标志,人类存在感蓝光等短波光的SWS,虽然眼睛没有反光膜,但这种导致感光细胞的衰老随着时间积累会导致视网膜变薄,从而引发黄斑变性,因此,本研究揭示的短波光损伤新机制给人类AMD病理产生提供了重要启示。
论文第一单位为上海海洋大学,上海海洋大学张博、冯毅栋,青岛华大吕美琪是文章共同第一作者,上海海洋大学鲍宝龙、李云凯教授、南方海洋科学与工程广东省实验室(湛江)赵娜研究员、青岛华大张要磊博士为本文通讯作者。成果的取得,得益于学校水产双一流学科、上海市“水生生物多样性保护与利用”重点创新团队和上海市“远洋渔业科学与技术”战略创新团队等的支持。今后将在此发现的基础上,进一步开展硬骨鱼类感短波光视锥视蛋白基因的适应性进化研究,为利用光谱开展鱼类的保护和利用服务。
(供稿:水产与生命学院)
